 Figure 1.
Figure 1.El Sindrome del Distress Agudo Respiratorio:
Mitos y Controversias
Joseph Varon, M.D., F.A.C.A., F.A.C.P
Olivier Wenker, M.D., D.E.A.A.
Resúmen Introducción Definición Incidencia Etiología Fisiopatología Manifestaciones Clínicas Diagnóstico Tratamiento Pronóstico Conclusiones Referencias
El término Sindrome de Distress Respiratorio del Adulto (ARDS), fue introducido por primera vez por Ashbaugh y Petty haca ya más de dos décadas. Desde entonces, nuestros conocimientos de esta entidad clínico-patológica ha aumentado significativamente. Sin embargo, se han alcanzado escasos progresos desde elpunto de vista terapéutico y la mortalidad permanece siendo alta. El ARDS se caracteriza por una lesión microvascular pulmonar difusa que produce un aumento de la permeabilidad y, de esta manera, edema pulmonar no-cardiogénico. Los estudios pulmonares de ventilación/perfusión han demostrado que la patogénesis más importante de la hipoxemia en el ARDS está relacionada con los shunts intrapulmonares. Los síntomas más comunes incluyen disnea, taquipnea, dolor retroesternal, y distress respiratorio de moderado a severo. En muchos casos el diagnóstico de ARDS se hace por exclusión. El plan principal en el tratamiento de este sindrome es el manejo de las alteraciones subyacentes que lo desencadenan. Hasta la fecha, no existen tratamientos farmacológicos específicos de probado valor para el tratamiento del ARDS. Una vez que se han encontrado las posibles causas potencialmente tratables e instituído el tratamiento, la terapia principal del ARDS es de soporte o sostén.
Palabras claves: ARDS, Edema Pulmonar, Distress Respiratorio, Edema Pulmonar no-cardiogénico
Ashbaugh y colaboradores, en 1967, decribieron un sindrome caracterizado por hipoxemia refractaria, infiltrados pulmonares difusos en la radiografía de tórax, y disminución de la compliancia pulmonar en un grupo de 12 pacientes que sufrían insuficiencia respiratoria aguda.1 Además, estos pacientes tenían diferentes enfermedades de base (p.e.pancreatitis, neumonía, trauma). Originalmente, esta condición era denominada por los autores como Sindrome de Distress Respiratorio Agudo del Adulto . Sin embargo, en 1971 los mismos autores renombraron al sindrome tal como lo conocemos ahora Sindrome de Distress Respiratorio del Adulto o Sindrome de Distress Respiratorio Agudo (ARDS).2 Desde entonces, nuestros conocimientos de este sindrome clínico-patológico han aumentado considerablemente. Aunque la gran mayoría de los pacientes con ARDS son manejados últimamente en las unidades de cuidados intensivos (ICU), el propósito de este artículo es presentar a los médicos de urgencias, intensivistas, cirujanos, y otros trabajadores de la salud una revisión de la fisiopatología, manifestaciones clínicas precoces, diagnóstico, manejo agudo y pronóstico así como también los mitos y controversias que surgen de este desvastador sindrome.
La definición de ARDS ha ido cambiando con el tiempo. A principios de los ´60 Burke y colaboradores utilizaban el término Fallo Respiratorio para describir un tipo de insuficiencia respiratoria caracterizado por la incapacidad de proveer una oxigenación y excreción de CO2 adecuada.3
Los términos que se utilizan frecuentemente al referirse a este sindrome incluyen: enfermedad de la membrana hialina del adulto, sindrome de insuficiencia respiratoria del adulto, atelectasias congestivas, sindrome del pulmón hemorrágico, pulmón de Da Nang, sindrome del pulmón rígido, pulmón de shock, pulmón blanco y pulmón húmedo entre otros.4
Aunque en la actualidad existen diversas opiniones acerca del uso del término apropiado de ARDS, todas las definiciones de este sindrome incluyen pacinetes que cumplen los siguientes criterios:5,6
1) Evidencia clínica de distress respiratorio.
2) Radiografía de tórax que muestra edema pulmonar bilateral.
3) Hipoxemia difícil de corregir con suplementos de oxígeno.
4) Evidencias hemodinámicas de presión en cuña de arteria pulmonar (PCWP) < 18 mm Hg.
5) Compliancia pulmonar estática menor de 40 mL/cm de agua.
La incidencia de ARDS varía dependiendo del criterio diagnóstico usado para su definición, así como de las enfermedades subyacentes que actúan como factores de riesgo. La incidencia estimada de ARDS en USA en los últimos años se calcula que está cerca de 150.000 nuevos casos cada año.7,8 En un estudio de Fowler y colaboradores, la incidencia variaba entre 2% (p.e. en pacientes post injerto aortocoronario o quemados) al 36% (p.e.aspiración gástrica).9 En una cohorte similar, Pepe y colaboradores, encontraron que la incidencia de ARDS oscilaba entre 8% (politraumatizados) al 38% (en pacientes con sepsis).10
Los factores de riesgo principales para el desarrollo de ARDS están descritos en la Tabla 1. Entre ellos, los más frecuentemente vistos en la práctica clínica son la sepsis, aspiración bronquial de contenido gástrico, politraumatismo, transfusiones de sangre masivas y sindromes de bajo gasto.9-11
| Aspiración de contenido gástrico Quemados Circulación Extracorpórea Coagulación Intravascular Diseminada Drogas Fracturas Múltiples Transfusiones Múltiples Ahogados Pancreatitis Hipotensión Prolongada Sepsis Inhalación de Tóxicos Traumatismo |
Tabla 1. Causas frecuentes de ARDS
La anormalidad básica en el ARDS es la ruptura de la barrera alveolo-capilar normal. Más aún, es ahora evidente que el ARDS no es simplemente una forma de edema pulmonar causado por un aumento de la permeabilidad microvascular, sini solo una manifestación de un defecto de permeabilidad más generalizado.12 Las investigaciones en los últimos años se han centrado sobre los posibles mediadores de la lesión pulmonar en el ARDS tales como radicales libres, proteinasas y, agentes solubles que incluyen las citoquinas, metabolitos del ácido araquidónico y proteínas con carga.5
Las consecuencias patofisiológicas del edema pulmonar en el ARDS incluyen una disminución de los volúmenes pulmonares, compliancia, y grandes shunts intrapulmonares (segmentos perfundidos pero mal ventilados). En todos los casos existe una disminución uniforme del volúmen residual que conribuye a la alteración de la ventilación/perfusión..13
Se ha pensado que un defecto en el surfactante podría ser parcialmente el responsable de los pequeños volúmenes pulmonares y que esto podría aumentar el edema del ARDS (se ha demostrado que el aumento de tensión de la superficie alveolar aumenta el contenido de agua pulmonar al disminuir la presión hidrostática intersticial).14,15 La disminución de la compliancia pulmonar es secundaria al aumento de la presión del pulmón edematoso, lo cual clínicamente aumenta el trabajo respiratorio y produce fatiga de los músculos respiratorios.15
En el ARDS se afecta predominantemente la vasculatura pulmonar. Un hallazgo muy frecuente en pacientes con ARDS es hipertensión pulmonar no relacionada con hipoxemia. Esto es causado por un aumento de 3 á 4 veces de las (PVR) resistencias vasculares pulmonares asociado con un aumento del trabajo del ventrículo derecho.16 La reversibilidad de la hipertensión pulmonar precoz (en las primeras 72 horas de comenzado el sindrome) con la administración de notroprusiato o isoproterenol sugiere que están involucrados mediadores inflamatorios vasoactivos, y que la naturaleza fija de la hipertensión pulmonar tardía se debe probablemente a una trombosis y fibrosis in situ que ocluye los lechos vasculares. Los estudios angiográficos pulmonares realizados dentro de las primeras 48 horas en pacientes con ARDS han demostrado que el 48% de los pacientes tienen defectos de relleno demostrables (trombos intravasculares) en vasos de más de 1 mm de diámetro.17
Los pacientes que han muerto de insuficiencia respiratoria generalmente muestran una disminución progresiva de la compliancia pulmonar, empeoramiento de la hipoxemia y, aumento progresivo del espacio muerto con hipercapnia. El exámen anatomopatológico de los pulmones de estos pacientes muestra fibrosis intersticial y alveolar extensas.18
Los signos y síntomas del ARDS sepueden desarrollar de una manera insidiosa en un período de horas o días después de iniciarse el evento (p.e.sepsis). A veces coincide el desarrollo de ARDS con la enfermedad predisponente (p.e.aspiración de contenido gástrico). Los síntomas comunes incluyen disnea, taquipnea, tos seca, dolor retroesternal, y agitación. El paciente manifiesta distress respiratorio de moderado a severo y puede tener cianosis. El exámen de los pulmones puede revelar estertores crepitantes y sibilancias.19 El cuadro clínico generalmente se deteriora, llegando eventualmente a ser necesaria la ventilación mecánica.
Cuando el paciente está en un hospital apropiado, los parámetros hemodinámicos (usando un catéter de Swan-Ganz), muestran una presión en cuña de capilar pulmonar (presión wedge, PCWP) normal o casi normal.5 Esto nos proporciona una información muy importante, dado que unas presiones de llenado del ventrículo izquierdo altas son patognomónicas del edema pulmonar cardiogénico. Por otra parte, una presiones normales o bajas son clara evidencia e que el edema es debido a un aumento de la permeabilidad (siempre que no esté en tratamiento con diuréticos). Si el paciente ha recibido previamente tratamiento con diuréticos, la PCWP puede ser falsamente baja. Las medidas de presión venosa central no aportan la misma información ya que los ventrículos derecho e izquierdo difieren considerablemente en su rendimiento y presiones de llenado.20
Una complicación frecuente en los pacientes con ARDS manejados con ventilación mecánica es el barotrauma (p.e neumotórax, neumomediastino, enfisema subcutáneo). Los pacientes con alto riesgo de barotrauma, son aquellos con compliancias pulmonares muy bajas (p.e.<20 cm de agua). El desarrollo de barotrauma se asocia muy estrechamente con la distensión alveolar, la cual se correlaciona muy bien con picos de presión inspiratoria altos.21
Debido a que no existen marcadores sensitivos específicos de lesión endotelial/epitelial pulmonar, actualmente el diagnóstico de ARDS se hace con criterios fisiológicos que por si mismos están discutidos.6 Como decíamos antes, el diagnóstico de ARDS se hace por exclusión. Sin embargo, algunos estudios de laboratorio y radiológicos pueden ser de utilidad.
Las gasometrías generalmente muestran hipoxemia severa (p.e. PaO2 50 mm Hg), y en muchos casos, hipocapnia. La hipoxemia en estos pacientes es muy difícil de corregir con oxígeno suplementario.5
 Figure 1.
Figure 1.
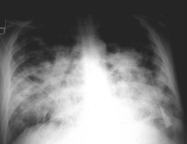
La radiografía de tórax típica muestra infiltrados difusos bilaterales.
Las consolidaciones pulmonares difusas con broncograma aéreo son características del ARDS post- intoxicación con humo. Radiológicamente es muy difícil de distinguir del edema alveolar o de la neumonía difusa.
Muchas veces es difícil de distinguir radiológicamente entre edema pulmonar cardiogénico y no-cardiogénico (o ARDS).19
Sin embargo, existen ciertos signos y patrones radiológicos que pueden ayudar a hacer la diferenciación, e incluyen:22
1.- En ARDS el tamaño de la silueta cardiovascular generalmente es normal.
2.- Los pacientes con ARDS tienen un distribución del edema pulmonar más periférica, parcheada e irregular, cuando se compara con el edema peri-hiliar, más homogéneo del edema pulmonar cardiogénico.
3.- La incidencia de derrame pleural en el ARDS es menor que en el edema pulmonar cardiogénico.
Algunos radiólogos consideran que el ancho del pedículo vascular generalemnte es mayor en el edema pulmonar cardiogénico que en el ARDS.23 Sin embargo, en nuestra experiencia estos hallazgos no son sensitivos ni específicos.
Hasta el día de hoy, no existen tratamientos farmacológicos de valor probado para el tratamiento del ARDS. Aunque se han usado ampliamente en la práctica cñinica tanto los corticoesteroides como la prostaglandina E1, estudios más recientes no han podido probar ningún beneficio en los resultados, compliancia pulmonar, shunts pulmonares, radiografía de tórax, severidad del score o supervivencia.24-27
La base fundamental del tratamiento del ARDS es el manejo de la causa subyacente que lo produce, siempre que sea posible. Desafortunadamente esto no siempre es así (como es el caso de aspiración de contenido gástrico, inhalación de humo, o traumatismo). Las causas tratables de ARDS incluyen sepsis, infecciones respiratorias y shock.
Una vez en la UCI, se debe colocar un catéter en AP (arteria pulmonar) en aquellos pacientes en los que se sospeche ARDS. Aunque en estudios prospectivos la presencia de catéter en AP no ha modificado los resutados,28 en nuestra experiencia el catéter de AP servirá como herramienta diagnóstica permitiéndonos el manejo del oxígeno y de los niveles de PEEP, cálculos de aporte de oxígeno, y la información necesaria para un manejo apropiado de los líquidos.26
Como en todo paciente crítico, es esencial en el manejo de los pacientes con ARDS el mantener la vía aérea, oxigenación adecuada y soporte circulatorio. Los objetivos de la terapia de soporte en el ARDS incluyen:
(1)Soporte Ventilatorio: Se debe instituir en cualquier paciente con ARDS con insuficiencia respiratoria o amenaza de insuficiencia respiratoria. Nosotros insistimos en la importancia de la ventilación asistida precoz, ya que si se prolonga la incapacidad de aportar el oxígeno necesario a los tejidos eventualmente se derivará en muerte celular y disfunción orgánica. Una vez que el paciente es intubado, el ventilador deberá colocarse en modo de ventilación asistida o mandataria intermitente, una fracción de oxígeno inspirada (FiO2) de 1 y un volúmen corriente de 8-12 cc/Kg de peso corporal ideal. La FiO2 deberá reducirse tan pronto como sea posible. El uso de modos alternativos de ventilación (p.e.Ventilación Jet de Alta Frecuencia, ventilación de relación inversa) no se ha probado que mejoren la supervivencia.
La PEEP es la vía más efectiva para mantener una oxigenación adecuada en pacientes con ARDS.29,30 Mejora la oxigenación a través del aumento de la capacidad funcional residual (FRC) y el reclutamiento de alveolos. Sin embargo la PEEP aún está discutida porque puede tener efectos deletéreos sobre el gasto cardíaco al disminuir el retorno venoso. En general la PEEP deberá ser dosificada gradualmente con cálculos serios del gasto cardíaco y aporte de oxígeno, permitiendo disminuir la FiO2 (y por lo tanto disminuir la toxicidad del oxígeno). Cuando los pacientes con ARDS son conectados a un ventilador, se debe comenzar con PEEP cuando es necesaria una FiO2 por encima de .5 para mantener una PaO2 > 55 mm Hg; el nivel inicial de PEEP deberá estar entre 3 y 5 cm de agua y se irá aumentando de a 2 cm de agua hasta que se obtenga una PaO2 > 55 mm Hg co una FiO2 de .5 o se produzca una disminución del aporte de oxígeno. Una vez instaurada, no se debe quitar abruptamente, porque puede producirse una caída severa de la PaO2.29 A pesar del hecho de que el uso de la PEEP mejora la oxigenación y e aporte de oxígeno, no existen evidencias científicas de que la PEEP mejore ni la lesión pulmonar ni la supervivencia.31,32
(2) Prevención, diagnóstico y tratamiento de las infecciones y sobreinfecciones.
(3) Minimizar la acumulación de líquido de edema pulmonar sin comprometer la función renal.
(4) Nutrición parenteral adecuada.
Se han estudiado gran número de vías de tratamiento en el ARDS. Los anticuerpos monoclonales contra los determinantes comunes de los liposacáridos bacterianos han demostrado resultados contradictorios en la prevención del desarrollo del ARDS en pacientes con sepsis. Otros tratamientos actualmente en investigación incluyen: pentoxifiline, factor inhibidor de necrosis tumoral (TNF) e inhibidores de la fosfodiesterasa.34-36 Es de particular interés el uso del surfactant en ARDS. Como mencionábamos antes, la deficiencia de surfactant es un componente sustancial del sindrome.14,24 Aunque los datos son dispares, parece ser que los humanos con ARDS tienen ya sea cantidades anormales de surfactant, composición anormal del mismo o ambos. Hay que incentivar estudios preliminares usando esta forma de tratamiento en pacientes con ARDS.33
La mortalidad en el ARDS en diferentes estudios permanece entre el 50% y el 70%. No se han demostrado diferencias estadísticamente significativas en los resultados desde 1971 a pesar del avance en la tecnología médica.5,9,11 De todo esto deducimos que la mejor calidad del soporte clínico no ha tenido impacto en la supervivencia.11
La mortalidad de los pacientes con ARDS se relaciona principalmente con el fallo multiorgánico mas que por la insuficiencia respiratoria. En un estudio de Montgomery y colab., menos del 20% de la mortalidad en ARDS era debida a insuficiencia respiratoria irreversible.37
Los pacientes que sobreviven al ARDS muestran sorprendentemente una alteración mínima de la función pulmonar a largo plazo.38,39 Pueden tener una alteración restrictiva moderada y déficit del intercambio gaseoso, y ocasionalmente pueden exibir obstrucción parcialñ y reversible de la vía aérea. 38,40 Las anormalidades a largo plazo es mas probable que ocurran en pacientes tratados durante períodos prolongados con suplementos de oxígeno mayores de 0.5.41-46
In ARDS, direct toxins, free radicals, charged particles and cytokines, all work on specific components of the alveolar capillary cells to result in altered permeability. Clearly, much more work will be needed to unravel the details of the cellular mechanism of normal and altered permeability. This new knowledge will lead to new early diagnostic and therapeutic approaches that may be started in the emergency department, hospital ward or ICU upon patient's presentation, perhaps leading to a decline in ARDS mortality.
1. Ashbaugh DG, Bigelow DB, Petty TL, Levine BE: Acute respiratory distress in adults. Lancet 1967;2:319-323. Volver al texto.
2. Petty TL, Ashbaugh DG: The adult respiratory distress syndrome. Clinical features, factors influencing prognosis and principles of management. Chest 1971;60:233-239. Volver al texto.
3. Burke JF, Pontoppidan H, Welch CE: High output respiratory failure: An important cause of death ascribed to peritonitis or ileus. Ann Surg 1963;158:581-595. Volver al texto
4. Taylor RW, Duncan CA: The adult respiratory distress syndrome. Res Medica 1983;1:17-21. Volver al texto.
5. Dal Nogare AR: Adult respiratory distress syndrome. Am J Med Sci 1989;298(6):413-430. Volver al texto.
6. Murray JF, Matthay MA, Luce JM, Flick MR: An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis 1988;138:720-723. Volver al texto
7. Task Force Report on Problems. Research Approaches: Needs. National Heart and Lung Institute. Respiratory Diseases. DHEW. Pub. No. NIH 73-432. 1972: 167-180. Volver al texto.
8. Bernard GR, Brigham KL: The adult respiratory distress syndrome. Annu Rev Med 1985;36:195-205. Volver al texto.
9. Fowler AA, Hamman RF, Good JT, Benson K, Baird M, Eberly D, Petty T, Hyers T: Adult respiratory distress syndrome. Risk with common predisposition. Ann Intern Med 1983;98:593-597. Volver al texto.
10. Pepe PE, Potkin R, Holtman-Reus D, Hudson L, Carico J: Clinical predictors of the adult respiratory distress syndrome. Am J Surg 1982;144:124-128. Volver al texto.
11. Petty TL: Indicators of risk, course and prognosis in adult respiratory distress syndrome (ARDS). Am Rev Resp Dis 1985;132:471. Volver al texto.
12. Kreuzfelder E, Joka T, Keinecke HO, Obertacke V: Adult respiratory distress syndrome as a specific manifestation of a general permeability defect in trauma patients. Am Rev Resp Dis 1988;137:95-99. Volver al texto.
13. Pontoppidian H, Geffin B, Lowenstein E: Acute respiratory failure in the adult. (Three part article) N Engl J Med 1972; 287:690-697, 743-752, 799-806. Volver al texto.
14. Hallman M, Spragg R, Harrell J, Moser K, Gluck L: Evidence of lung surfactant abnormality in respiratory failure. J Clin Invest 1982;70:673-683. Volver al texto.
15. Petty TL, Silvers W, Paul G, Stanford R: Abnormalities in lung elastic properties and surfactant function in adult respiratory distress syndrome. Chest 1979;75:571-574. Volver al texto.
16. Zapol WM, Snider MR: Pulmonary hypertension in severe acute respiratory failure. N Engl J Med 1977;296:474-480. Volver al texto.
17. Greene R, Zapol WM, Snider MR, Reid L, Snow R, O'Connell R, Novelline R: Early bedside detection of pulmonary vascular occlusion during acute respiratory failure. Am Rev Respir Dis 1981;124:593-601. Volver al texto.
18. Zapol WM, Trelstad RL, Coffey JW, Tsai I, Salvador RA: Pulmonary fibrosis in severe acute respiratory failure. Am Rev Respir Dis 1979;119:547-554. Volver al texto.
19. Fraser RG, Pare JAP, Pare PD, Fraser RS, Genereux GP: Diagnosis of Diseases of The Chest. Third edition. Philadelphia: W.B. Saunders Co, 1991:1823-1968. Volver al texto.
20. Touissant GP, Burgess JH, Hanipson LG: Central venous pressure and pulmonary wedge pressure in critical surgical illness: A comparison. Arch Surg 1974;109:265-269. Volver al texto.
21. Dellinger PR: Complications of mechanical ventilation. In: George RB.(Ed.):Pulmonary and Critical Care Update. American College of Chest Physicians. 1989;5(10):1-8. Volver al texto.
22. Milne ENC, Pistolesi M, Miniati M, Giuntini C: The radiologic distinction of cardiogenic and noncardiogenic edema. Am J Roentgenol 1985;144:879-894. Volver al texto.
23. Pistolesi M, Milne ENC, Miniati M, Giuntini C: The vascular pedicle of the heart and the vena azygos. Part II: Acquired heart disease. Radiology 1984;152(1):9-17. BVolver al texto.
24. Luce JM, Montgomery AB, Marks JD, Turner J, Metz CA, Murray JF: Ineffectiveness of high-dose methylprednisolone in preventing parenchymal lung injury and improving mortality in patients with septic shock. Am Rev Respir Dis 1988;138:62-68. Volver al texto.
25. Bernard GR, Luce J, Sprung C, Reinaldo J, Tate R, Sibblad W, Kariman K, Higgins S, Bradley R, Metz C, Harris T, Brigham K: High-dose corticosteroids in patients with the adult respiratory distress syndrome. N Engl J Med 1987;317:1565-1570. Volver al texto.
26. Chatterjee K: Congestive heart failure. Advances in treatment. Hemodynamic studies: Their uses and limitations. Am J Cardiol 1989;63:3D-7D. Volver al texto.
27. Melot C, Leujeune P, Leemam M, Moraine JJ, Neaije R: Prostaglandin E1 in the adult respiratory distress syndrome. Am Rev Respir Dis 1989;139:106-110. Volver al texto.
28. Robin ED: The cult of the Swan-Ganz catheter. Ann Intern Med 1985;103:445-446. Volver al texto.
29. Weisman IM, Rinaldo JE, Rogers RM: Positive end-expiratory pressure in adult respiratory failure. N Engl J Med 1982;307:1381-1384. Volver al texto.
30. Bone RC, Maunder R, Slotman G, Silverman H: An early test of survival in patients with the adult respiratory distress syndrome: the PaO2/FiO2 ratio and its differential response to conventional therapy. Prostaglandin E1 study Group. Chest 1989;96:849-851. Volver al texto.
31. Hopewell PC: Failure of positive end-expiratory pressure to decrease lung water content in alloxan-induced pulmonary edema. Amer Rev Respir Dis 1979;120:813-819. Volver al texto.
32. Springer RR, Stevens PM: The influence of PEEP on survival of patients in respiratory failure. Amer J Med 1979;66:196-202. Volver al texto.
33. Enhorning G: Surfactant replacement in adult respiratory distress syndrome. Am Rev Resp Dis 1989;140:281-285. Volver al texto.
34. Welsh CH, Lien D, Worthon GS, Weil JV: Pentoxifylline decreases endotoxin-induced pulmonary neutrophil sequestration and extravascular protein vascular accumulation in the dog. Am Rev Respir Dis 1988;138:1106-1114. Volver al texto.
35. Petty TL, Bone RC, Gee MH, Hudson LD, Hyers TM: Contemporary clinical trials in acute respiratory distress syndrome. Chest 1992;101:550-552. Volver al texto.
36. Metz C, Sibbald WJ: Anti-Inflammatory therapy for acute lung injury. A review of animal and clinical studies. Chest 1991;100:1110-1119. BVolver al texto.
37. Montgomery AB, Stager MA, Carrico CJ, Hudson L: Causes of mortality in patients with the adult respiratory distress syndrome. Am Rev Respir Dis 1985;132:485-489. Volver al texto.
38. Elliott CG, Morris A, Cengiz M: Pulmonary function and exercise gas exchange in survivors of adult respiratory distress syndrome. Am Rev Respir Dis 1981;123:492-495. BVolver al texto.
39. Lakshminarayan S, Stanford R, Petty TL: Prognosis after recovery from adult respiratory distress syndrome. Am Rev Respir Dis 1976;113:7-16. Volver al texto.
40. Simpson DL, Goodman M, Spector S, Petty TL: Long-term follow-up and bronchial reactivity testing in survivors of the adult respiratory distress syndrome. Am Rev Respir Dis 1978;117:449-454. Volver al texto.
41. Fanconi S, Kraemer R, Weber J, Tschaeppeler H, Pfenninger J: Long-term sequelae in children surviving adult respiratory distress syndrome. J Pediatr 1985;106(2):218-222. Volver al texto.
42. Elliott CG, Rasmusson BY, Capro RO, Morris AH, Jensen RL: Prediction of pulmonary function abnormalities after adult respiratory distress syndrome (ARDS). Am Rev Respir Dis 1987;135:634-638. Volver al texto.
43. Matthay MM: The adult respiratory distress syndrome: Definition and prognosis. Clin Chest Med 1990;11:575-578. Volver al texto.
44. Rinaldo JE: Prognosis of the adult respiratory distress syndrome: Inappropriate pessimism. Chest 1986;90:470-471. Volver al texto.
45. Hyers TM, Fowler AA: Adult respiratory distress syndrome: Causes, morbidity and mortality. Fed Proc 1986;45:25-28. Volver al texto.
46. Rinaldo JE: Indicators of risk, course and prognosis in adult respiratory distress syndrome.(Letter) Am Rev Respir Dis 1986;133:431. Volver al texto.

José Ramón Aguilar